王文新教授团队在《ACS Nano》上发表最新成果
近日,学校王文新教授团队继在JACS上发表核酸治疗递送系统的突破性工作后,该工作在蛋白治疗递送系统上也实现了重大突破,并以“Guanidyl-Rich Poly(β Amino Ester)s for Universal Functional Cytosolic Protein Delivery and Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR) Cas9 Ribonucleoprotein Based Gene Editing”为题发表在《ACS Nano》上。
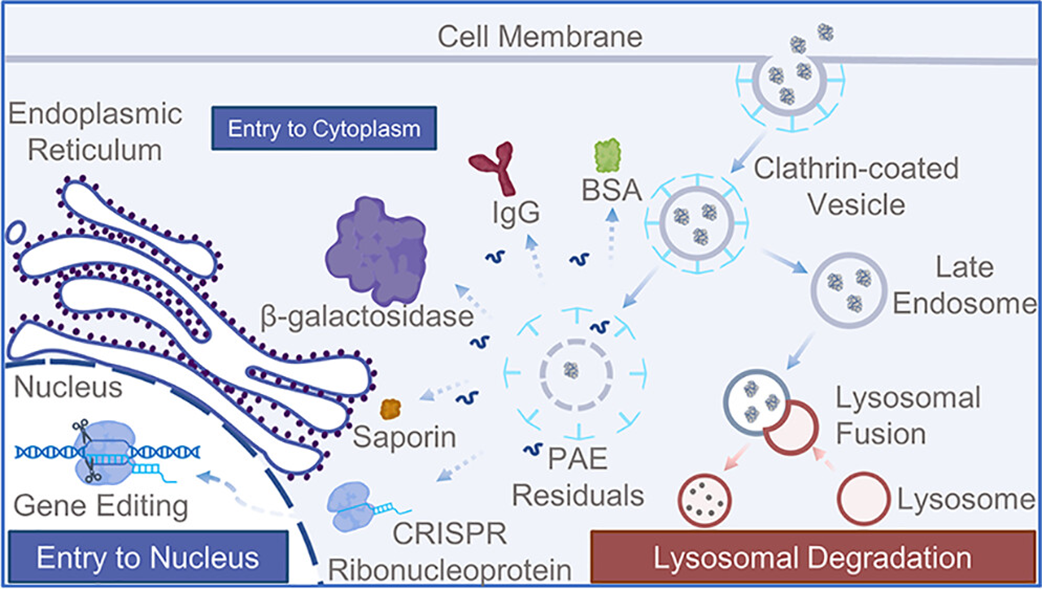
蛋白质疗法在众多方面拥有远超小分子药物的明显优势,但是由于蛋白质递送技术的限制,特别是基于核酸酶的基因编辑疗法,在临床上的应用十分有限。王文新教授领导的研究团队采用苯胍基(PG)修饰聚β氨基酯(PAEs),提高了其在细胞质内传递蛋白质的适应性。传统的PAEs载体和其他阳离子聚合物通过静电作用与核酸分子(如RNA和DNA)复合成为纳米颗粒,从而完成细胞转染。由于蛋白表面复杂的多电荷分布,传统的PAEs和其他阳离子聚合物在蛋白质递送上的效率远不如核酸递送。王文新教授团队基于多年核酸递送载体的研发经验,首次通过苯胍基(PG)修饰将PAEs开发成为有效的蛋白递送载体。结合近年来飞速发展的CRISPR基因编辑技术,PG修饰的PAEs将推动基因疗法在遗传病等疑难杂症治疗上的应用。
聚β氨基酯L3和L3PG介导的胞质蛋白在细胞内的递送
该工作系统性地评估了PG基团对PAEs与蛋白结合、细胞内吞、蛋白功能保护以及溶酶体逃逸的影响。与未修饰的PAEs (L3)相比,富含苯胍基的PAEs (L3PG)具有更高的蛋白质结合能力和细胞内吞效率。这两种PAEs均表现出可递送多种蛋白(分子量30-464 KDa,等电点4.3-9)的能力,且递送效果远超商业蛋白转染试剂PULsin和Pierce Protein Transection Reagent。更值得关注的是,L3PG成功地将CRISPR Cas9核糖核蛋白(RNP)递送到表达绿色荧光蛋白(GFP)的HeLa细胞中,并实现了80%以上的GFP表达敲除。
王文新教授为学校合肥高等研究院讲席教授,担任我校精准医学创新研究院院长、公共卫生学院学术院长。2010年在欧洲组织工程和再生医疗国际协会(TERMIS-EU)年会上荣获再生医学领域青年科学家奖,在2011年荣获由爱尔兰国家自然科学基金委颁发的爱尔兰科学基金会首席科学家奖,并在2014年获得由蝴蝶宝贝关爱中心(DEBRA协会)颁发的杰出EB患者服务奖。王文新教授与他带领的研究团队主要从事高分子可控聚合方法的前沿机理和临床应用研究,具体为高分子可控聚合机理和动力学控制策略及其在生物功能材料设计与合成中的两大方向应用:组织工程学—水凝胶以及其他功能性生物材料单独或结合干细胞疗法在骨关节炎、关节软骨缺损、骨缺损、牙科骨/软组织修复、皮肤创伤修复等医疗方向的广泛应用;基因治疗—十余年深耕研发报道多种高效聚合物结构用于基因递送,并通过可控聚合首次攻克和发明了超支化聚β氨基酯该大类材料家族用于遗传物质的体外和体内递送,并成功应用于,包括EB基因替代和编辑疗法等在内,多种拥有完全自主知识产权的核酸药物的临床转化验证。
王文新教授的基础研究以及商业化转化工作获得了国际同行的普遍认可和跟进研究报道,目前已发表235篇学术论文,并参与编纂5本学术专著的部分章节,其工作已相继被多家国际知名媒体采访和报道56次。在科研成果的转化方面,王文新教授创建了应用和转化自己研发技术的5家生物技术公司,并拥有34项发明专利,其中30项已有企业合作进行技术转化,现担任27个国家研究委员会和基金会的评审专家和委员会成,被11家国际同行评议杂志聘为编委,已先后117次被国际会议和大学邀请作为主要报告人,并作为组织者、会议主席和召集人主办了33次国际学术会议。
撰稿:医学院 王贤青
核稿:王文新
编辑:宣传部 夏雅凤、陈颖
审稿:彭玉地
